
本文转载自“BioArt”
2013年,邓宏魁教授课题组率先用小分子化合物得到化学诱导的多能性干细胞(Cheimcal-iPSCs, ciPSCs),一时间震动了整个干细胞领域;2015年12月,该课题组又在Cell杂志上发表封面文章,研究发现化学重编程过程中的一个类似于胚外内胚层细胞的中间态——An extraembryonic endoderm (XEN)-like state,并据此大幅提升了化学诱导的多潜能干细胞(CiPS细胞)的诱导效率。
在此基础上,6月22日,邓宏魁课题组和柴真课题组合作在Cell Stem Cell杂志上发表了题为“Direct Reprogramming of Fibroblasts via a Chemically Induced XEN-like State”的研究论文,进一步将“XEN类似状态”的研究从体细胞“重编程”扩展到了“转分化”。此外,该研究进一步把化学诱导的“XEN类似细胞”状态建立为一个稳定,可扩增,多功能体外细胞工具系,该工具系不仅可支持iPSC的诱导,还能“转分化”为成为成熟的,具有功能的神经细胞 (外胚层)和肝脏细胞 (内胚层)。值得一提的是,这是继今年4月份邓宏魁课题组在Cell上报道了具有全能性特征的多潜能干细胞系(EPS细胞)之后的又一力作。
论文解读:
人工诱导多能干细胞(Induced Pluripotent Stem Cells,iPSs)的方法被誉为干细胞的PCR。该方法在原理上和方法上看起来似乎很简单:在成纤维细胞中过表达四个在胚胎干细胞中具有重要作用的转录因子—Oct4,Sox2,Klf4和c-Myc —可以成功将细胞从分化状态重编程至与胚胎干细胞类似的多能性状态(该项工作之前,干细胞领域普遍认为通过几个确定的转录因子逆分化成体细胞在原理和技术上都是“mission impossible”;该项工作之后,人们好奇这么“显而易见”的方法为什么早没有人想到)自从该革命性的技术问世(2006),干细胞领域工作者为该方法的最终临床应用不懈努力。
十余年来, 诱导iPS的方法安全性不断提高,从最初的插入型外源DAN (逆转录或慢病毒载体),非插入外源DNA (质粒,腺病毒,仙台病毒)发展到无外源DNA介入(mRNA,蛋白,小分子)(遗憾的是,在之前的探索中,安全性与高效性难以两全—越安全的诱导方法,获得iPS的效率越低,周期越长)。
在众诱导方法中, 纯化学(小分子)方法具有操作简单,易改进的的优势(比如使用组合和浓度,添加周期/时间等),应用前景广阔(然而,至少在2013年之前,当人们描述纯化学诱导的研究前景时,最常用的词不是“目标”,而是“梦想”。当时,很多研究者对化学小分子的“微调”性质是否能当起转录因子般的重任有保留;再者,在重编程过程中,转录因子Oct4(诱导iPS的四个Yamanaka factor之一)似乎难以取代)。2013年夏,邓宏魁教授课题组登顶成功,首次报道了用七种小分子化合物得到化学诱导的多能性干细胞(Cheimcal-iPSCs, ciPSCs),领域震动【1】。 2009年至今,邓教授课题组在小分子调控细胞命运领域发表了多项重要工作; 在此,本文仅从“展开系统性工作”的角度,讨论该课题组在获得ciPSCs之后的两篇系列报道 (Cell, 2015;Cell Stem Cell, 2017)。
2015年,CiPS方法学改进和提出新机制:“A XEN-like State Bridges Somatic Cells to Pluripotency during Chemical Reprogramming”(Cell封面文章,见下图)。

此项工作是该课题组两年前Science工作的深入和拓展。工作主要内容包括1)优化方法:优化和细化了小分子诱导的protocol;2)新机制:发现化学诱导的细胞在重编程过程中经过了独特的中间状态,处于该状态的细胞具有体外内胚层(extra-embryonic endoderm,XEN)的分子特征和功能,被定义为XEN类似细胞(下图)。
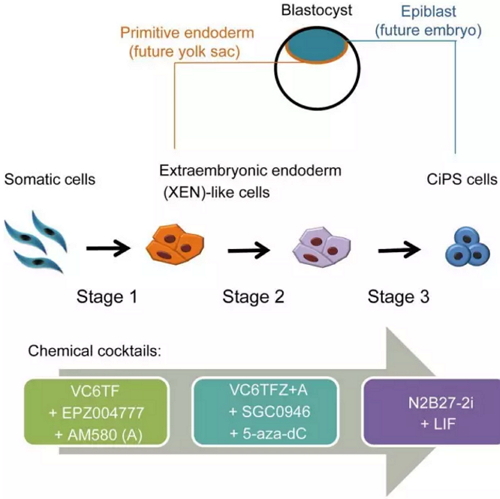
在化学重编程早期产生的一个上皮样细胞的中间状态,这一中间状态的细胞共表达Sall4, Gata4, Gata6和Sox17等转录因子,在细胞的基因表达谱和体内发育能力上类似于胚外内胚层(XEN)细胞
实际上,在13年的Science文章上(下图),作者已经发现胚外内胚层基因( Gata4,Gata6, Gata17)和多能基因Sall4之间的相互作用对化学诱导iPSCs的形成有重要作用(在体内,Sall4 介导的去分化过程参与两牺动物肢体再生);更早以前,同实验室报道了过表达Gata4和Gata6可用于诱导iPSCs。
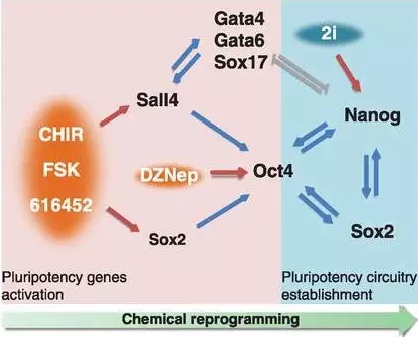
在此项工作中,作者通过细化诱导条件,在分子水平和功能上定义了一个“XEN类似状态”, 进一步拓展了Science工作中观察到的几个XEN代表性基因在诱导过程中显著表达的结果。这个新机制为什么重要? iPS机制研究的基本问题之一是“路径问题” 。越来越多的工作根据在不同时间点上对重编程过程中的细胞进行实时观测,转录组测序和细胞表面标志物检测, 绘制了重编程过程中的高分辨率分子地图(molecular roadmap)。 目前,通过表达转录因子诱导iPS的过程可以大致可分为几个比较明确的阶段,各阶段可以用特异性的分子标记物加以区别。 简单来说,基于转录因子诱导iPS的机制研究越来越偏向 “自古华山一条道”,但是基于小分子诱导iPS的转录分析提示通往罗马的道路不止一条,骑马的和坐轿的看到的风景可能不一样。这是一个典型的由方法创新引发的理论创新。
2017年6月,XEN类似状态的功能升级。
6月22日,邓宏魁教授课题组与柴真课题组合作在Cell Stem Cell杂志上在线发表了题为“Direct Reprogramming of Fibroblasts via a Chemically Induced XEN-like State”的研究论文。该工作将“XEN类似状态”的研究从体细胞“重编程”扩展到了“转分化”。
什么是“转分化”?“转分化”一般指不同成熟细胞之间的直接转化,这种转化并不经过干细胞状态,从而可能得以避免传统干细胞治疗(干细胞和iPSCs细胞定向分化)中的“成瘤性”风险。 目前,实现重编程和转分化的实验手段主要依赖特定转录因子过表达。2015-16年,由小分子诱导的成体细胞转分化方法取得重大突破,多个实验室报道了使用不同的“小分子鸡尾酒” ,可以从人或小鼠成体细胞诱导具有功能的成熟神经细胞,心脏细胞等多种功能性细胞。 值得一提的是,2015年邓宏魁课题组和裴钢课题组“背靠背”在Cell Stem Cell杂志发表文章通,报道了通过小分子化合物将成纤维细胞诱导为具有功能的神经细胞【3,4】(下图1),这一成果还被选入封面论文(下图2)。
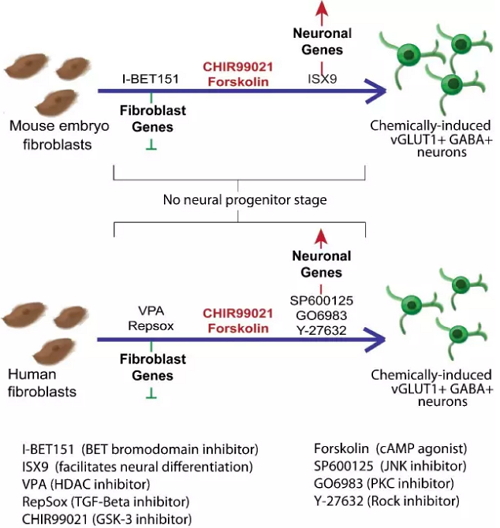
1、图片引自:Babos, K., & Ichida, J. K. (2015). Small molecules take a big step by converting fibroblasts into neurons. Cell stem cell, 17(2), 127-129.
在上小分子化合物述诱导转分化的研究的基础之上,邓教授课题组进一步把化学诱导的“XEN类似细胞”状态建立为一个稳定,可扩增,多功能体外细胞工具系,该工具系不仅可支持iPSC的诱导,还能“转分化”为成为成熟的,具有功能的神经细胞 (外胚层)和肝脏细胞 (内胚层)(下图)。
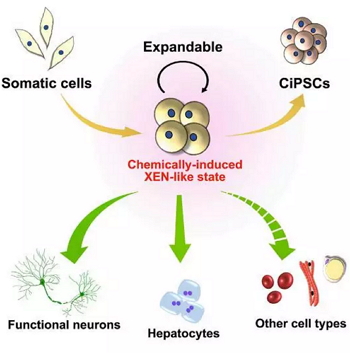
总结:邓宏魁教授课题组小分子重编程、去分化三部曲是一个典型的由方法创新引发的理论创新的系统性工作。此系列工作对 如何在实验中提炼新理论,用新理论指导新研究方向,并且通过系列工作把新理论“做大做强”提供了范式。
特别说明:2013年Science和2015年的Cell、Cell Stem Cell三篇论文中,邓宏魁课题组的赵扬博士都是共同通讯作者或者第一作者兼通讯作者,赵扬博士现为北京大学分子医学研究所PI。
参考文献:
1、Hou, P., Li, Y., Zhang, X., Liu, C., Guan, J., Li, H., ... & Deng, H. (2013). Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds. Science, 341(6146), 651-654.
2、Zhao, Y., Zhao, T., Guan, J., Zhang, X., Fu, Y., Ye, J., ... & Deng, H. (2015). A XEN-like state bridges somatic cells to pluripotency during chemical reprogramming. Cell, 163(7), 1678-1691.
3、Li, X., Zuo, X., Jing, J., Ma, Y., Wang, J., Liu, D., ... & Xu, J. (2015). Small-molecule-driven direct reprogramming of mouse fibroblasts into functional neurons. Cell Stem Cell, 17(2), 195-203.
4、Hu, W., Qiu, B., Guan, W., Wang, Q., Wang, M., Li, W., ... & Zhao, H. (2015). Direct conversion of normal and Alzheimer’s disease human fibroblasts into neuronal cells by small molecules. Cell Stem Cell, 17(2), 204-212.

