本文转载自“药智网”。

中国的癌症发病率和死亡率一直保持着逐年上升的趋势,从2010年开始已经成为主要的致死原因,成为了中国的一个主要公共卫生问题。这个逐渐增加的压力有相当大的一部分可以归于人口的增长和老龄化以及社会人口统计的变化。2016年,影响因子为144.8的CA-A Cancer Journal for Clinicians刊登了我国学者发表的一篇Cancer Statisticsin China, 2015的文章,即《2015中国癌症统计报告》。作者分析了代表6.5%人口的72个地区基于人群的癌症登记(2000~2011),用以估计2015年癌症新增病例数与死亡病例数。结果发现,2015年预计新增429.2万例癌症病例,死亡281.4万例。
《中国证券报》于2017年7月发表的一篇名为《抗肿瘤药物市场取得重大突破》援引财汇金融大数据终端数据称,2016年,全球用于治疗肿瘤的药物开销为1100亿美元,远高于其他疾病的用药开销。庞大的患者人群、巨大的市场空间与远未被满足的临床治疗需求,吸收越来越多的制药企业投入到抗肿瘤药物的研制中,其中,不乏国内企业的身影。
9月8日-10日,药智网携手中国药房杂志社联合主办的《2017中国医药创新高峰论坛•暨医药企业研发实力百强榜发布》在重庆耀世启幕,会议将隆重发布《2017药品研发实力排行榜》(包括“总榜”、“化药榜”、“中药榜”、“生物药榜”、“品牌榜”),哪些抗肿瘤药物领军企业将凭借其夯实的研发实力入围《2017药品研发实力排行榜》?欢迎大家莅临会场观摩。
本文基于药智药品注册与受理数据、CDE网站上的药物临床试验登记与信息公示平台,再结合充分的文献检索,介绍了各种适应证下国内企业自主或合作研发且已进行临床试验公示阶段的小分子抗肿瘤药物的以下信息:
*药理作用特点,尤其是作用靶点
*申报受理与批准时间,可以反映出政策上的支持力度
*临床试验信息,主要包括:
体现出临床试验类型与主要目的的试验专业名称
试验公示时间
试验状态
试验计划/实际入组人数与首例受试者入组时间
所述文献包括:期刊文献、学位论文、媒体报道与公司自主披露的信息。
1.呼吸系统肿瘤
根据《2015中国癌症统计报告》,2015年我国预计新增肺癌患者73.33万例,死亡61.02万例,其发病率与死亡率均居榜首。
1.1 BPI-15086
BPI-15086是由贝达药业股份有限公司自主开发的第三代EGFR抑制剂类小分子靶向抗肿瘤药物。目前与之相关的信息较少,然而根据公示的临床试验信息,该药也能克服T790M突变所致的耐药。其原料药与片剂的临床申报于2015年11月获受理(1.1类),后经特殊审评于2016年8月获准临床。
*晚期非小细胞肺癌-最高状态:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2016年9月20日公示了“BPI-15086在既往EGFR-TKIs治疗后进展的T790M突变晚期非小细胞肺癌(NSCLC)患者中的Ⅰ期临床研究(登记号:CTR20160704)”,该试验尚未启动受试者招募,计划入组80人。
1.2 BPI-9016M
BPI-9016M是由贝达药业股份有限公司自主研发的Axl抑制剂类小分子靶向抗肿瘤药物,其作用靶点还包括HGFR,目前与该药相关的信息较少。其原料药与胶囊的临床申报于2016年4月获CDE受理(1.1类),后经特殊审评于2017年1月获准临床。
*c-Met异常的晚期非小细胞肺癌-最高状态:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2016年10月9日公示了一项“BPI-9016M在c-Met异常的晚期NSCLC患者中安全性、耐受性、疗效和药代动力学的Ib期临床研究(登记号:CTR20160757)”,该项试验尚未启动受试者招募,计划入组50人。
1.3 Hemay 020
Hemay020是由中国医药健康产业股份有限公司与天津和美生物技术有限公司联合研发的一种EGFR不可逆抑制剂类小分子靶向抗肿瘤药物,2012年7月由中国医药健康产业股份有限公司全资子公司海南三通三洋药业有限公司按1.1类递交原料药与胶囊剂的临床申报,后经特殊审评于2014年7月获批临床。
*非小细胞肺癌-最高状态:Ⅰ期,受试者招募中
药物临床试验登记与信息公示平台于2015年6月25日公示了一项“小分子EGFR酪氨酸激酶不可逆抑制剂Hemay 020胶囊用于晚期实体瘤的Ⅰ期临床试验”,登记号为CTR20150294。该项试验包括剂量递增研究与扩展研究两部分,其中扩展研究以晚期EGFR野生型非小细胞肺癌(或未测定基因型)患者为研究对象,尚处于受试者招募阶段,首例受试者于2015年7月3日入组,共计划入组55人。
1.4 PLB1003
PLB1003是由北京浦润奥生物科技有限责任公司按1.1类申报的抗肿瘤药物,暂无与其作用靶点相关的信息,然根据其已公示的临床试验提供的受试者入选标准,该药可能作用于ALK受体酪氨酸激酶。
PLB1003原料药与胶囊的新药临床申报于2015年12月获CDE受理,后经特殊审评于2016年8月获准临床、
*ALK-阳性的晚期非小细胞肺癌-Ⅰ期,最高状态:受试者招募阶段
药物临床试验登记与信息公示平台于2017年2月公示了一项“针对ALK阳性的晚期非小细胞肺癌(NSCLC)患者口服PLB1003胶囊的一项单中心、开放性、单臂、剂量递增Ⅰ期研究(CTR20170023)”,该项试验已经启动受试者招募,计划入组30人,但尚未披露首例受试者入组时间。
1.5 SPH1188-11
SPH1188-11是由上海医药集团股份有限公司研发的EGFR抑制剂类小分子靶向抗肿瘤药,其原料药与片剂的1.1类新药临床申报于2016年4月获CDE受理,后经特殊审评于2016年12月获准临床。
*局部晚期或转移性非小细胞肺癌-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2017年6月9日公示了一项“Ⅰ期、开放、SPH1188-11治疗局部晚期或转移性非小细胞肺癌的安全性、耐受性、药代动力学及疗效初步探索研究方案(登记号:CTR20170556)”,该试验已启动受试者招募,首例受试者于2017年7月21日入组,共计划入组18~36人。
1.6 伯瑞替尼
伯瑞替尼是由北京浦润奥生物科技有限公司于2014年4月申报临床的1.1类新药,后经特殊审评于2015年6月获批临床,拟药用其肠溶胶囊。专业数据库中与之相关的信息较少,有报道称,伯瑞替尼的作用靶点是c-met。
*c-met异常的非小细胞肺癌-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年4月27日公示了一项“考察伯瑞替尼在c-Met异常的NSCLC患者中的耐受性和药代动力学的I期、开放、多中心、剂量递增及扩展研究(登记号:CTR20160228)”,该项试验尚处于受试者招募阶段,首例受试者于2016年4月25日入组,计划入组30人。
1.7 丁二酸复瑞替尼
丁二酸复瑞替尼是由重庆复创医药研究有限公司研发的第2代ALK抑制剂类抗肿瘤药物,2015年3月,在新药创制专项的支持下递交了原料药与胶囊的临床申报(1.1类),后经特殊审评于2015年10月20日获准进行临床试验。
*ALK-阳性非小细胞肺癌-最高状态:Ⅱ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2016年7月6日公示了一项“丁二酸复瑞替尼在ALK阳性晚期恶性实体瘤患者的剂量探索I期研究,及在ALK阳性非小细胞肺癌患者的II期研究(登记号:CTR20160339)”,该项试验尚未启动受试者招募,共计划入组196人。
1.8 甲磺酸艾氟替尼
甲磺酸艾氟替尼(AST2818)为上海艾力斯医药科技有限公司研制的1.1类新药,专门针对EGFRT790M耐药的非小细胞肺癌。甲磺酸艾氟替尼在临床前研究中,对T790M耐药肿瘤展现良好的抑制肿瘤活性;该药在动物体内分布广泛,并可以通过血脑屏障。该药在临床前研究未发现心脏毒性,眼毒性和高血糖等不良反应,已展现良好的安全性。
甲磺酸艾氟替尼原料药与片剂的新药临床申报于2016年1月获CDE受理,后经特殊审评于2016年9月获准临床。
*晚期非小细胞肺癌-最高状态,Ⅰ/Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2017年6月28日公示了一项“在1/2代EGFR-TKI治疗后进展的晚期NSCLC患者中评价甲磺酸艾氟替尼有效性和安全性的多中心、单臂的Ⅰ/Ⅱ期临床试验(登记号:CTR20170447)”。该项试验已启动受试者招募,首例受试者于2017年6月2日入组,共计划入组81人。
1.9 马来酸艾维替尼
马来酸艾维替尼(AC0010)是由杭州艾森医药研究有限公司在新药创制专项的支持下研发的第三代EGFR酪氨酸激酶抑制剂类小分子靶向抗肿瘤药物,其能克服T790M突变所致的耐药,其结构式如下图所示。
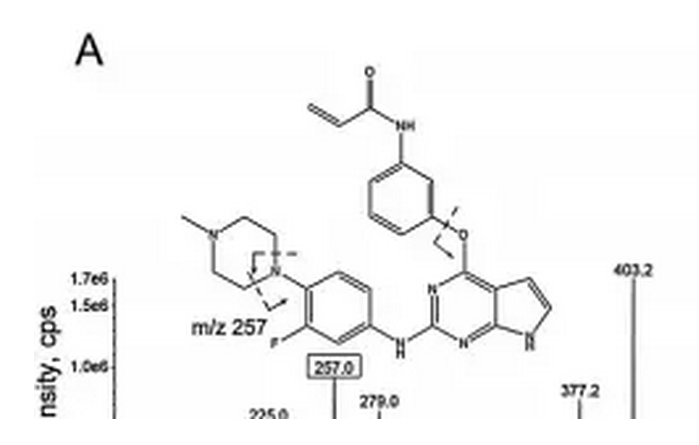
艾森医药在新药创制专项支持下按1.1类递交的马来酸艾维替尼原料药与胶囊剂的临床申报于2013年8月获CDE受理,后经特殊审评于2014年9月获准临床;而后在新药创制专项的支持下递交的补充申报亦于2016年6月获CDE受理,并于9月获准。
*晚期非小细胞肺癌-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年12月30公示了一项“马来酸艾维替尼胶囊治疗EGFRT790M突变阳性的晚期NSCLC患者的疗效和安全性的单臂、多中心、II期临床试验(登记号:CTR20161018)”,该试验尚处于受试者招募阶段,首例受试者于2017年5月18日入组,共计划入组222人。
AnnalsofOncology杂志于2016年发表了的一篇文章披露了马来酸艾维替尼于国外同期进行的Ⅰ期临床试验(NCT02274337)的初步结果。该项试验在非小细胞肺癌患者出现第一代TKI耐药后对其采用艾维替尼治疗,并进行了药物剂量的爬坡试验,剂量从50mgqd升高至600mgqd。经过疗效评判,研究的总体ORR为38.2%,175mg和300mg阶段的ORR为62%,350mg阶段与600mg阶段的ORR分别为55.6%。最常见的不良反应为腹泻(44%)、皮疹(20%)与瘙痒(16%)。
1.10 马来酸吡咯替尼
马来酸吡咯替尼是由江苏恒瑞医药股份有限公司自主研发的EGFR与HER-2不可逆的抑制剂。2011年5月,恒瑞医药按1.1类递交了马来酸吡咯替尼原料药与片剂的临床申报,后经特殊审评于2012年5月获准临床。2015年5月又在新药创制专项的支持下递交了补充申请。
*非小细胞肺腺癌-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年8月31日公示了一项“马来酸吡咯替尼片治疗HER2突变晚期非小细胞肺腺癌的有效性和安全性的Ⅱ期临床研究(登记号:CTR20160434)”,该项临床试验尚处于受试者招募阶段,首例受试者于2016年10月9日入组,共计划入组55人。
1.11 沃利替尼
沃利替尼是由和记黄埔医药(上海)有限公司自主研发的小分子c-met抑制剂类抗肿瘤药物。和记黄埔医药于2012年3月按1.1类递交沃利替尼原料药与片的临床申报,后经特殊审评于2013年3月获准临床。和记黄埔医药先后于2013年9月、2015年5月与2016年2月递交了3次补充申报。
*EGFR+且治疗后进展的非小细胞肺癌-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2015年3月24日公示了一项“临床Ib期针对EGFR+且治疗后进展的非小细胞肺癌,评估沃利替尼合并吉非替尼的安全性、代谢和初步疗效(登记号:CTR20140879)”,该试验尚处于受试者招募阶段,首例受试者于2015年4月3日入组,计划入组32人。
*MET外显子14突变的局部晚期或转移性肺肉瘤样癌(PSC)-最高状态:Ⅱ期,受试招募阶段
药物临床试验登记与信息公示平台于2016年8月26日公示了一项“评价沃利替尼治疗晚期或转移性肺肉瘤样癌患者的有效性、安全性和耐受性的多中心、开放的II期临床研究(登记号:CTR20160581)”,该试验尚处于受试者招募阶段,首例受试者于2017年2月10日入组,共计划入组46人。
1.12 西奥罗尼
西奥罗尼是由深圳微芯生物科技有限责任公司自主研发的小分子靶向抗肿瘤药,其作用靶点包括:AororaB、VEGFR1,2,3、PDGFRα、β,c-Kit。
2012年10月,深圳微芯生物科技有限责任公司按1.1类递交了西奥罗尼原料药与胶囊的临床申报,后经特殊审评于2013年8月获准临床。
*复发性难治性小细胞肺癌-最高状态:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2017年7月27日公示了一项“西奥罗尼胶囊治疗复发难治小细胞肺癌的单臂、多中心、非随机、开放性探索疗效和安全性的临床试验”,登记号为CTR20170765,该项临床试验尚未启动受试者招募,共计划入组27人。
1.13 盐酸安罗替尼
盐酸安罗替尼是由正大天晴集团药业股份有限公司研发并申报的多靶点小分子抗肿瘤药物,临床前研究显示,该药物可抑制VEGFR-2、VEGFR-3、EGFR、c-Kit、PDGF、FDFR以及c-Met等多种因子。该药于2010年7月递交原料药与胶囊剂的临床申报,经特殊审评于2011年4月获临床批件,并于2014年12月与2015年10月先后两次递交补充申报,其中2014年12月的补充申报受新药创制专项的支持。
2017年3月,正大天晴启动了原料药与胶囊剂的上市申报,且被纳入了优先审评与特殊审评,根据其临床试验公示信息,申请上市的适应证很有可能是非小细胞肺癌。
*非小细胞肺癌-最高状态:Ⅱ期,已完成,有结果
药物临床试验登记与信息公示平台上共公示了两项盐酸安罗替尼治疗非小细胞肺癌的临床试验。其中,CTR20130315是盐酸安罗替尼胶囊治疗晚期非小细胞肺癌随机、双盲、安慰剂平行对照、多中心Ⅱ期临床试验,该试验以三线及以上晚期非小细胞肺癌为研究对象,且已于2014年12月30日完成试验;根据第九届中国肿瘤内科大会、第四届中国肿瘤医师大会、中国抗癌协会肿瘤临床化疗专业委员会2015年学术年会(2015年7月1日,中国北京)上公布的试验结果,2013年08月至2014年05月,全国13家中心完成117例患者入组,并按1:1的比例随机分入盐酸安罗替尼组12mgqd组与安慰剂对照组,2014年11月16日揭盲进行统计分析(仍有9例试验组受试者仍在访视中)。117例病例全部进入全分析数据集FAS。试验组与安慰剂组对比,总的中位PFS延长了3.6个月(4.83个月和1.23个月,P<0.0001),风险比(HR)为0.320(95%CI:0.200~0.511,P<0.0001)。试验组与安慰剂组的肿瘤进展率曲线在治疗第一周期末就开始发生分离,试验组患者肿瘤进展率显著低于安慰剂组。对可能影响无进展生存期PFS的因素(年龄、性别、吸烟史、临床分期、先前治疗是否获得缓解、组织病理学分型、转移灶数、治疗线数、既往是否接受肺癌根治术、既往EGFR-KTI获益及EFGR是否突变等)进行分层分析表明,试验组与安慰剂组相比,中位PFS均有显著差异。两组病人疗后最佳疗效,试验组比安慰剂组总的疾病控制率DCR提高了45.96%(93.33%Vs47.37%,P<0.0001)。试验组比安慰剂组,总的不良反应发生率增多了34.04%(分别为86.67%vs52.63%,p=0.0001)。试验组中具体不良反应(按照发生率排序)为高血压(53.33%)、TSH升高(36.67%)、手足症候综合征(28.33%)、TG升高(26.67%)、TC升高(25.00%)、咳嗷(21.67%)、腹泻(21.67%)、LDL升高(16.67%)、咯血(16.67%)、口腔黏膜炎(13.33%)、咽痛(13.33%)等,与安慰剂对比差异有显著统计学意义
另一项临床试验CTR 20150454是盐酸安罗替尼胶囊治疗晚期非小细胞肺癌随机、双盲、安慰剂对照、多中心ⅡB期临床试验,该项试验同样以晚期非小细胞肺癌为研究对象,并于2017年1月5日完成试验。
*小细胞肺癌-最高状态:Ⅱ期,尚未招募
药物临床试验登记与信息公示平台于2017年2月24日公示了一项“盐酸安罗替尼胶囊三线及三线以上治疗小细胞肺癌随机、双盲、安慰剂对照、多中心II期临床试验(登记号:CTR20170146)”,该项试验尚未启动受试者招募,计划入组90人。
1.14 盐酸莎巴比星
盐酸莎巴比星是意大利Menarini Ricerche SpA公司通过延长和修饰碳水化合物组成合成的新型蒽环类药物,其结构式如下图所示。
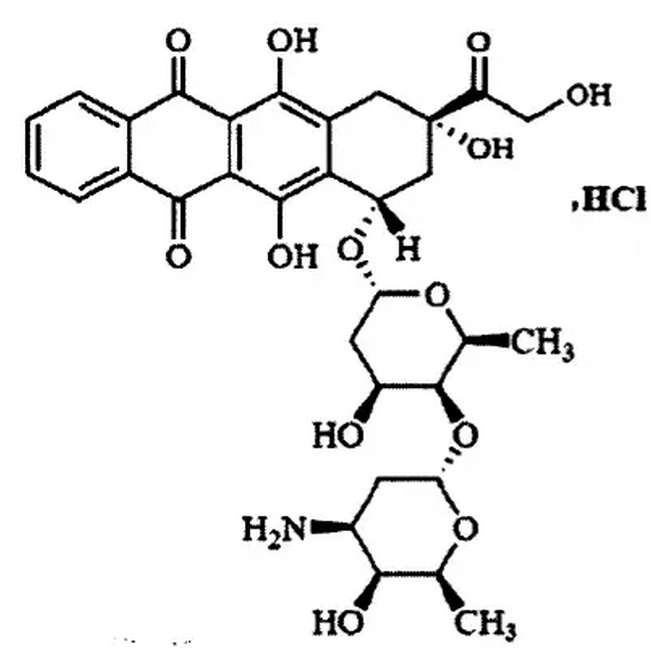
莎巴比星作为具有双糖链的新型蒽环类抗生素,其作用机制与多柔比星等同类药物相同,均属于拓扑异构酶Ⅱ抑制剂,但莎巴比星具有更强的药效与更弱的心脏毒性。临床前数据显示,莎巴比星对包括多柔比星耐药细胞系在内的多种细胞系均具有较好的抗肿瘤活性。
2012年10月,合肥合源药业有限公司按1.1类递交了盐酸莎巴比星原料药与注射用剂型的临床申报,后经特殊审评于2013年5月获准临床。
*初发的小细胞肺癌广泛期患者-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2015年4月22晶公示了一项“注射用盐酸莎巴比星联合顺铂治疗小细胞肺癌(广泛期)安全性、耐受性及药代动力学Ⅰ期临床研究”,登记号为CTR20150203。该项临床试验尚处于受试者招募阶段,首例受试者于2014年8月28日入组,共计划入组15人。
*难治或复发的小细胞肺癌(广泛期)患者-最高阶段:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2014年12月30日公示了一项“注射用盐酸莎巴比星治疗难治或复发的小细胞肺癌(广泛期)安全性、耐受性及药代动力学Ⅰ期临床研究方案”,登记号为CTR 20140763。该项试验尚处于受试者招募阶段,共计划入组23人,但暂未披露首例受试者入组时间。
1.15 盐酸西莫替尼
盐酸西莫替尼是由AdvenChen实验室发现的小分子EGFR酪氨酸激酶抑制剂类抗肿瘤药,2007年1月,先声药业与该公司签署了盐酸西莫替尼的联合研究协议,从而获得了该药在中国的权益。2010年8月,先声药业按1.1类递交了盐酸西莫替尼原料药与片剂的临床申报,后经特殊审评于2011年7月获准进行临床试验。
*非小细胞肺癌-最高状态:Ⅰ期,完成受试者招募
药物临床试验登记与信息公示平台于2014年7月8日公示了一项“盐酸西莫替尼片在晚期NSCLC患者中连续给药安全性、耐受性、药动学Ⅰb期临床试验(登记号:CTR20131337)”,该项试验已经完成受试者招募,首例受试者于2013年4月15日入组,原计划入组24~30人,未披露实际入组人数
2. 泌尿生殖系统肿瘤
《2015中国癌症统计报告》中涉及6种泌尿生殖系统肿瘤。其中,2015年同,子宫癌预计新增6.34万例,死亡2.18万例;卵巢癌预计新增5.21万例,死亡2.25万例;前列腺癌预计新增6.03万例,死亡2.26万例;睾丸癌预计新增4000例,死亡1000例;肾癌预计新增6.68万例,死亡2.34万例;膀胱癌预计新增8.05万例,死亡3.29万例。
2.1 CM082
CM082是由卡南吉医药科技(上海)有限公司通过VIC模式(即:风投+知识产权项目+CRO外包服务)进行开发的一种可同时抑制VEGFR与PDGFR的小分子靶向药物,另有报道称,其作用靶点还包括;c-kit与flt3。CM082原料药与胶囊剂的1.1类临床申报最早于2011年5月获受理,后经特殊审评于2012年4月获准临床。该药除了肿瘤适应证,还拟用于治疗湿性年龄相关性黄斑变性。
*既往VEGFR-TKI一线治疗失败的转移性肾癌-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2017年1月10日公示了“CM082联合依维莫司治疗肾癌患者的一项随机、双盲、平行分组Ⅱ期临床研究(登记号:CTR20160987)”,该项试验已启动受试者招募,首例受试者于2017年3月10日入组,共计划入组216人。
2.2 SHR3680
SHR3680是由江苏恒瑞医药股份有限公司研发的一种雄激素受体拮抗剂类小分子抗肿瘤药物,拟用于治疗前列腺癌。
恒瑞医药递交的SHR3680原料药与片剂临床申报于2014年2月获CDE受理,后经特殊审评于2015年10月获准临床。
*晚期去势抵抗性前列腺癌-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年2月2日公示了一项“SHR3680在晚期去势抵抗性前列腺癌患者中的耐受性、药代动力学及疗效的Ⅰ/Ⅱ期临床研究(登记号:CTR20160047)”,该项试验尚处于受试者招募阶段,首例受试者入组时间为2016年3月28日,共计划入组120~140人。
2.3 氟唑帕利
氟唑帕利是由江苏豪森药业股份有限公司自主研发的一种小分子PARP抑制剂类小分子靶向抗肿瘤药物。其化学结构式如下图所示。
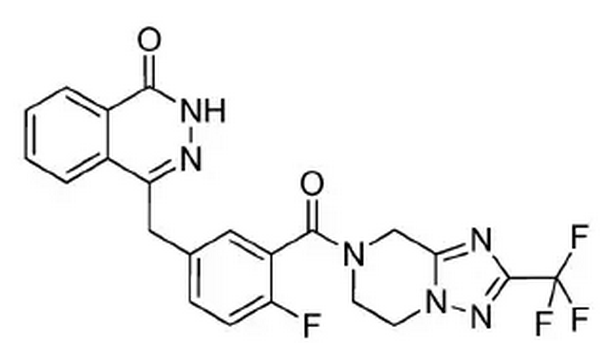
PARP抑制剂通过抑制肿瘤细胞DNA损伤修复、促进肿瘤细胞发生凋亡,从而增效放疗及烷化剂和铂类药物化疗的疗效。
江苏豪森药业股份有限公司及其子公司连云港宏创医药有限公司分别按1.1类递交的氟唑帕利原料药与胶囊的临床申报于2012年12月获CDE受理,后经特殊审评于2013年9月获准临床。
*晚期卵巢癌-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2017年3月10日公示了一项“氟唑帕利联合阿帕替尼治疗卵巢癌或三阴性乳腺癌的I期临床研究”,登记号为CTR20170154。该项试验以先前治疗失败的晚期卵巢癌患者或乳腺癌患者为研究对象,尚处于受试者招募阶段,首例受试者入组时间为2017年3月9日,共计划入组39人。
2.4 普克鲁胺
普克鲁胺是由中国药科大学王广基院士、孙建国副教授团队与苏州开拓药业合作开发的1.1类新药,暂无其作用机制的权威披露,但根据其通用名,很可能与已上市的恩杂鲁胺同属于雄激素受体拮抗剂剂类抗肿瘤药。
2014年2月,开拓药业在新药创制专项的支持下,递交了普克鲁胺原料药与片的临床申报,后经特殊审评于2015年3月获准。2016年9月与2017年4月,又先后两次递交补充申报。
*转移性去势抵抗性前列腺癌-最高状态:Ⅱ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2017年8月11日公示了一项“评价普克鲁胺片治疗转移性去势抵抗性前列腺癌的开放、随机、多中心的Ⅱ期临床研究”,登记号为CTR20170177,该试验尚未启动受试者招募,计划共入组105人。
2.5 沃利替尼
沃利替尼是由和记黄埔医药(上海)有限公司自主研发的小分子c-met抑制剂类抗肿瘤药物。和记黄埔医药于2012年3月按1.1类递交沃利替尼原料药与片的临床申报,后经特殊审评于2013年3月获准临床。和记黄埔医药先后于2013年9月、2015年5月与2016年2月递交了3次补充申报。
*晚期肾细胞癌-最高状态:Ⅲ期(全球),2017年6月刚启动
2.6 西奥罗尼
西奥罗尼是由深圳微芯生物科技有限责任公司自主研发的小分子靶向抗肿瘤药,其作用靶点包括:AororaB、VEGFR1,2,3、PDGFRα、β,c-Kit。
2012年10月,深圳微芯生物科技有限责任公司按1.1类递交了西奥罗尼原料药与胶囊的临床申报,后经特殊审评于2013年8月获准临床。
*复发性难治性卵巢癌-最高状态:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2017年7月19日公示了一项“西奥罗尼胶囊治疗复发难治晚期卵巢癌的单臂、多中心、非随机、开放性探索疗效和安全性的临床试验”,登记号为CTR20170767,该项临床试验尚未启动受试者招募,共计划入组30人。
2.7 盐酸安罗替尼
盐酸安罗替尼是由正大天晴集团药业股份有限公司研发并申报的多靶点小分子抗肿瘤药物,临床前研究显示,该药物可抑制VEGFR-2、VEGFR-3、EGFR、c-Kit、PDGF、FDFR以及c-Met等多种因子。该药于2010年7月递交原料药与胶囊剂的临床申报,经特殊审评于2011年4月获临床批件,并于2014年12月与2015年10月先后两次递交补充申报,其中2014年12月的补充申报受新药创制专项的支持。
2017年3月,正大天晴启动了原料药与胶囊剂的上市申报,且被纳入了优先审评与特殊审评,根据其临床试验公示信息,申请上市的适应证很有可能是非小细胞肺癌。
*晚期肾细胞癌-最高状态:Ⅱ期,完成受试者招募
临床试验登记与信息公示平台于2015年7月3日公示了“盐酸安罗替尼胶囊对经TKI治疗无效或不耐受的晚期肾细胞癌多中心Ⅱ期临床试验(登记号:CTR20150331)”,该项试验已完成受试者招募,首例受试者入组时间为2014年3月3日,计划入组16人,未披露实际入组人数。
临床试验登记与信息公示平台于2015年7月6日公示了“盐酸安罗替尼胶囊治疗晚期肾细胞癌的随机、阳性药物平行对照、多中心Ⅱ期临床试验(登记号:CTR20150129)”,该项试验于已完成受试者招募,首例受试者入组时间为2014年1月21日,计划入组180人,暂未披露实际入组人数。
3. 内分泌系统肿瘤
根据《2015中国癌症统计报告》,2015年我国预计新增甲状腺癌患者9.0万例,死亡6.8万例。
3.1 甲苯磺酸多纳非尼
多纳非尼是由苏州泽璟生物制药有限公司将已上市的索拉非尼分子上的一个甲基取代为三氘代甲基后而开发的1.1类化学新药,药用其甲磺酸盐片剂。多纳非尼可抑制VEGFR、血小板衍生生长因子(PDGF)受体等多种受体酪氨酸激酶的活性,也可直接抑制各种Raf激酶以及下游的Raf/MEK/ERK信号传导通路,抑制肿瘤细胞增殖和肿瘤血管的形成,发挥双重抑制、多靶点阻断的抗肿瘤作用。
2011年12月,泽璟生物制药按1.1类递交了甲磺酸多纳非尼原料药与片的临床申报,后经特殊审评于2012年11月获准临床;2015年4月又在新药创制重大专项的支持下递交了原料药与片剂的补充申报,后于当年10月底获批。
*局部晚期/转移性放射性碘难治性分化型甲状腺癌(RAIR-DTC)-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年8月23日公示了一项“评价甲苯磺酸多纳非尼片治疗局部晚期/转移性RAIR-DTC有效性和安全性的多中心、随机、开放的Ⅱ期临床试验(登记号:CTR20160220)”,该项试验尚处于受试者招募阶段,首例受试者于2017年3月22日入组,共计划入组44人。
3.2盐酸安罗替尼
盐酸安罗替尼是由正大天晴集团药业股份有限公司研发并申报的多靶点小分子抗肿瘤药物,临床前研究显示,该药物可抑制VEGFR-2、VEGFR-3、EGFR、c-Kit、PDGF、FDFR以及c-Met等多种因子。该药于2010年7月递交原料药与胶囊剂的临床申报,经特殊审评于2011年4月获临床批件,并于2014年12月与2015年10月先后两次递交补充申报,其中2014年12月的补充申报受新药创制专项的支持。
2017年3月,正大天晴启动了原料药与胶囊剂的上市申报,且被纳入了优先审评与特殊审评,根据其临床试验公示信息,申请上市的适应证很有可能是非小细胞肺癌。
*碘治疗抵抗局部晚期或转移性分化型甲状腺癌-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2015年11月9日公示了“盐酸安罗替尼胶囊对于碘治疗抵抗局部晚期或转移性分化型甲状腺癌的随机双盲、安慰剂对照、多中心Ⅱ期临床试验(登记号:CTR20150735)”,首例受试者于2015年9月1日入组,共计划入组120人。
*晚期甲状腺髓样癌-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2015年12月16日公示了“盐酸安罗替尼胶囊对于晚期甲状腺髓样癌患者的疗效与安全性随机双盲、安慰剂对照的多中心Ⅱb期临床试验”,该项试验尚处于受试者招募阶段,首例受试者于2015年9月1日入组,计划入组90人。
4.皮肤系统肿瘤
根据《2015中国癌症统计报告》,2015年,我国预计新增黑色素瘤患者8000例,死亡3200例。
4.1 SHR6390
SHR6390是由江苏恒瑞医药股份有限公司自主研发的选择性CDK4/6抑制剂类小分子抗肿瘤药物。2014年举办的第八届中国肿瘤学术大会暨第十三届海峡两岸肿瘤学术会议上报道了SHR6390对食管鳞癌细胞系的作用及机制。在筛选的5种食管鳞癌细胞系中,SHR6390的IC50值范围0.47-16.6uM,Eca-9706为相对耐药细胞系(IC50值最高)。所有细胞系均表达PRb,P16仅在耐药细胞系Eca-9706中检测到表达。敏感细胞系中,SHR6390显著下调PRb表达,细胞周期G0/G1阻滞显著;而在耐药细胞系Eca-9706中,SHR6390处理前后PRb表达及细胞周期均无明显变化
*黑色素瘤-最高状态:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2016年2月29日公示了一项“SHR6390片在晚期黑色素瘤患者中的耐受性及药代动力学I期临床研究(登记号:CTR20160067)”,该项试验尚未启动受试者招募,计划入组30人左右、
4.2 盐酸安罗替尼
盐酸安罗替尼是由正大天晴集团药业股份有限公司研发并申报的多靶点小分子抗肿瘤药物,临床前研究显示,该药物可抑制VEGFR-2、VEGFR-3、EGFR、c-Kit、PDGF、FDFR以及c-Met等多种因子。该药于2010年7月递交原料药与胶囊剂的临床申报,经特殊审评于2011年4月获临床批件,并于2014年12月与2015年10月先后两次递交补充申报,其中2014年12月的补充申报受新药创制专项的支持。
2017年3月,正大天晴启动了原料药与胶囊剂的上市申报,且被纳入了优先审评与特殊审评,根据其临床试验公示信息,申请上市的适应证很有可能是非小细胞肺癌。
*晚期黑色素瘤-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2017年7月14日公示了一项“盐酸安罗替尼用于治疗恶性黑色素瘤的方案探索Ⅰ期临床试验(登记号:CTR20170676),该项试验尚处于受试者招募阶段,首例受试者于2016年10月10日入组,共计划入组50人。
5.乳腺癌
根据《2015中国癌症统计报告》,2015年我国预计新增乳腺癌患者27.24万例,死亡7.07万例。
5.1 Hemay 022
Hemay022是一种小分子EGFR/HER2酪氨酸激酶不可逆抑制剂类抗肿瘤药,由峡江和美药业有限公司按1.1类递交的原料药与片剂的临床申报于2013年5月获CDE受理,后经特殊审评于2014年9月获准临床。
*晚期HER2乳腺癌-最高状态:Ⅰ期
药物临床试验登记与信息公示平台于2015年5月29日公示了一项“小分子EGFR/HER2酪氨酸激酶不可逆抑制剂Hemay022治疗晚期HER2阳性乳腺癌剂量递增(登记号)期临床研究(登记号:CTR20150326)”,该项临床试验尚处于受试者招募阶段,首例受试者于2015年9月30日入组,计划入组45~57人。
药物临床试验登记与信息公示平台还于2017年7月24日公示了一项“小分子EGFR/HER2酪氨酸激酶不可逆抑制剂Hemay022联合依西美坦治疗晚期ER阳性和Her2阳性乳腺癌Ib期临床研究(登记号:CTR20170726)”,该项临床试验尚未启动受试者招募,共计划入组39~48人。
5.2 氟唑帕利
氟唑帕利是由江苏豪森药业股份有限公司自主研发的一种小分子PARP抑制剂类小分子靶向抗肿瘤药物。其化学结构式如下图所示。
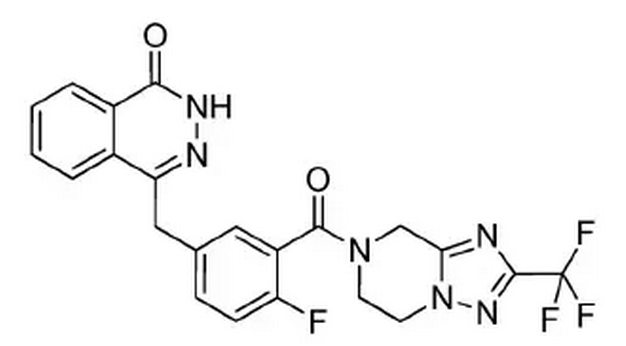
PARP抑制剂通过抑制肿瘤细胞DNA损伤修复、促进肿瘤细胞发生凋亡,从而增效放疗及烷化剂和铂类药物化疗的疗效。
江苏豪森药业股份有限公司及其子公司连云港宏创医药有限公司分别按1.1类递交的氟唑帕利原料药与胶囊的临床申报于2012年12月获CDE受理,后经特殊审评于2013年9月获准临床。
*晚期乳腺癌-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2017年3月10日公示了一项“氟唑帕利联合阿帕替尼治疗卵巢癌或三阴性乳腺癌的I期临床研究”,登记号为CTR20170154。该项试验以先前治疗失败的晚期卵巢癌患者或乳腺癌患者为研究对象,尚处于受试者招募阶段,首例受试者入组时间为2017年3月9日,共计划入组39人。
5.3 马来酸吡咯替尼
马来酸吡咯替尼是由江苏恒瑞医药股份有限公司自主研发的EGFR与HER-2不可逆的抑制剂。2011年5月,恒瑞医药按1.1类递交了马来酸吡咯替尼原料药与片剂的临床申报,后经特殊审评于2012年5月获准临床。2015年5月又在新药创制专项的支持下递交了补充申请。
药物临床试验登记与信息公示平台于2017年3月27日公示了“马来酸吡咯替尼片联合卡培他滨对比拉帕替尼联合卡培他滨治疗HER2阳性转移性乳腺癌的Ⅲ期临床研究(登记号:CTR20170251)”,该项试验尚未启动受试者招募。
药物临床试验登记与信息公示平台于2016年7月29日公示了“马来酸吡咯替尼片联合卡培他滨对比安慰剂联合卡培他滨治疗HER2阳性转移性乳腺癌的Ⅲ期临床研究(登记号:CTR20160442)”,该项临床试验尚处于受试者招募阶段,首例受试者于2016年7月20日入组,计划入组350人。
2015年ASCO会议上首次报告吡咯替尼Ⅰ期临床结果,在入选的36例HER-2阳性转移性乳腺癌患者中,剂量从80、160、240、320和400mg递增,1次/d,每28d为1个周期,结果显示吡咯替尼具有较好的耐受性,不良反应主要表现为腹泻(41.7%)、恶心(8.3%)、皮疹(8.3%)和口腔黏膜溃疡(8.3%),以1~2级为主。
6.软组织肉瘤
盐酸安罗替尼
盐酸安罗替尼是由正大天晴集团药业股份有限公司研发并申报的多靶点小分子抗肿瘤药物,临床前研究显示,该药物可抑制VEGFR-2、VEGFR-3、EGFR、c-Kit、PDGF、FDFR以及c-Met等多种因子。该药于2010年7月递交原料药与胶囊剂的临床申报,经特殊审评于2011年4月获临床批件,并于2014年12月与2015年10月先后两次递交补充申报,其中2014年12月的补充申报受新药创制专项的支持。
2017年3月,正大天晴启动了原料药与胶囊剂的上市申报,且被纳入了优先审评与特殊审评,根据其临床试验公示信息,申请上市的适应证很有可能是非小细胞肺癌。
*软组织肉瘤-最高状态:Ⅱ期,已完成,有结果
临床试验登记与信息公示平台于2015年7月31日公示了“盐酸安罗替尼胶囊治疗软组织肉瘤随机、双盲、安慰剂对照(2:1)、多中心注册临床试验(Ⅱ期,登记号:CTR20150531)”,该项试验已完成受试者招募,首例受试者于2015年5月15日入组,共入组233人
临床试验登记与信息公示平台于2015年7月3日公示了“盐酸安罗替尼胶囊治疗晚期软组织肉瘤的Ⅱ期临床试验(登记号:CTR20130324)”,该项临床试验已经完成,共有166名受试者参与了该项临床试验。
2016年6月3日至7日,美国临床肿瘤学会(ASCO)2016年会在美国芝加哥召开,会上来自中国医学科学院肿瘤医药的依荷芭丽·迟教授口头报告了CTR20130324试验的研究结果。
该项试验采用了非随机化、开放标签、单臂试验设计,在入组的166名受试者中,有154人可接受有效性评价。12周无进展生存率(PFR12w)57.23%,中位PFS为5.63个月,完全缓解率(ORR)为11.45%,疾病控制率(DCR)为73.49%,以腺泡状软组织肉瘤患者的疗效最明显,其PFR12w、ORR与DCR依次为76.92%、46.15%与100%。所有患者均耐受安罗替尼,常见的3-4级不良反应(AE)包括:高血压(8)、气胸(5)、甲状腺功能低下(2)、蛋白尿(1)、手足皮肤反应(1)、腹泻(1)、甘油三脂升高(2)、高糖血症(1)。
7.神经系统肿瘤
伯瑞替尼
伯瑞替尼是由北京浦润奥生物科技有限公司于2014年4月申报临床的1.1类新药,后经特殊审评于2015年6月获批临床,拟药用其肠溶胶囊。专业数据库中与之相关的信息较少,有报道称,伯瑞替尼的作用靶点是c-met。
*ZM阳性脑胶质瘤患者-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年9月12日公示了一项“考察伯瑞替尼在ZM融合基因阳性复发高级别脑胶质瘤患者中耐受性和药代动力学的I期、开放、剂量递增研究(登记号:CTR20160683)”,该项试验尚处于受试者招募阶段,计划入组24人,但尚未披露首例受试者入组时间。
8.消化系统肿瘤
《2015中国癌症统计报告》中共涉及9种消化系统肿瘤。其中,2015年唇、口腔、咽部(鼻咽部除外)癌症预计新增4.81万例,死亡2.21万人;鼻咽癌预计新增6.06万例,死亡3.41万例;食管癌预计新增47.79万例,死亡37.5万例;胃癌预计新增67.91万例,死亡49.8万例;结直肠癌预计新增37.63万例,死亡19.1万例;肝癌预计新增46.61万例,死亡42.21万例;胆囊癌预计新增5.28万例,死亡4.07万例;胰腺癌预计新增9.01万例,死亡7.94万例;喉癌预计新增2.64万例,死亡1.45万例。
8.1 MB07133
MB07133是由西安新通药物研究公司研制的1.1类肝癌靶向新药,该药基于国外HepDirect肝靶向技术,使其靶向地浓集于肝脏,肝脏中的药物浓度是血液中的15倍、骨髓的10倍,持续7天静脉给药,其肝脏中的浓度是血液中的250倍。MB07133避免了肝动脉插管,提高疗效的同时大幅降低了药物的全身暴露水平,减少血浆、骨髓及肝脏外组织的毒性。国外Ⅰ期临床试验结果显示,MB07133对晚期肝癌患者的平均生存期为9.7个月,其中30%患者的生存期更长,可达14.9个月。
西安新通药物研究有限公司按1.1类递交的MB07133原料药与注射用剂型的临床申报于2013年5~6月获CDE受理,后经特殊审评于2014年3月获准临床。
不可切除的肝细胞癌、肝内胆管细胞癌患者-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年11月22日公示了一项“评估注射用MB07133治疗的安全性、耐受性及药代动力学特征的多中心、开发、剂量递增的临床研究”,登记号为:CTR20160143。该项试验尚处于受试者招募阶段,共计划入组36人,但尚未披露首例受试者的入组时间。
8.2 福大赛因
福大赛因是福州大学科研人员自主研发的一种具有两新性的双取代酞菁类光动力治疗药,其结构式如下图所示。
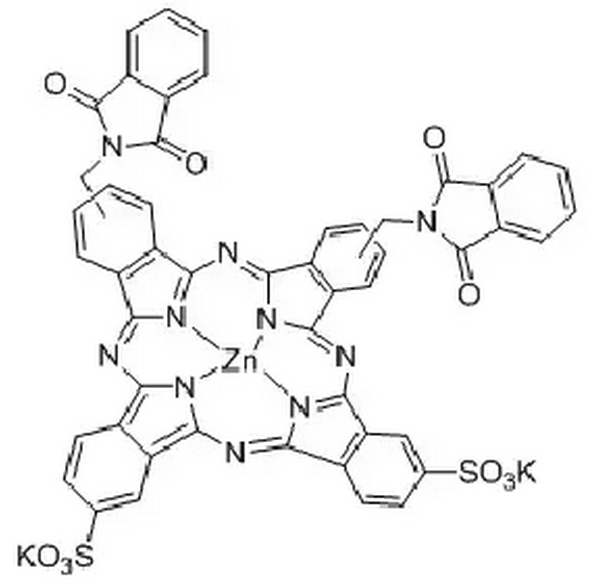
细胞与动物试验表明,福大赛因对肿瘤细胞和组织具有一定的靶向性特征,且光动力活性高。治疗波长(670nm)下穿透生物组织深度较深,暗毒性的皮肤光毒性小。
福大赛因原料药与注射液最早于2008年7月获临床批件,申请人为福建省龙华药业有限责任公司。该公司而后递交的补充申报于2011年7月获CDE受理,后经特殊审评于2014年1月获临床批件。
完全梗阻或不完全梗阻的原发性食管癌-最高状态:Ⅱ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2016年5月12日公示了一项“评价用福大赛因注射液光动力治疗完全或不完全梗阻原发性食管癌患者有效性安全性的开放多中心II期临床试验(登记号:CTR20150429)”,该项试验尚未启动受试者招募,计划入组170人。
8.3 氟唑帕利
氟唑帕利是由江苏豪森药业股份有限公司自主研发的一种小分子PARP抑制剂类小分子靶向抗肿瘤药物。其化学结构式如下图所示。
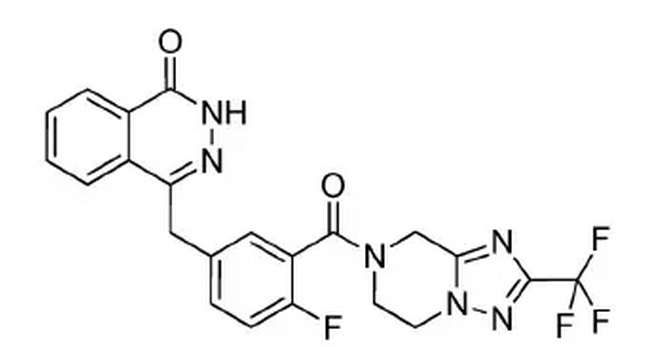
PARP抑制剂通过抑制肿瘤细胞DNA损伤修复、促进肿瘤细胞发生凋亡,从而增效放疗及烷化剂和铂类药物化疗的疗效。
江苏豪森药业股份有限公司及其子公司连云港宏创医药有限公司分别按1.1类递交的氟唑帕利原料药与胶囊的临床申报于2012年12月获CDE受理,后经特殊审评于2013年9月获准临床。
晚期胃癌-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2017年1月25日公示了一项“氟唑帕利联合阿帕替尼和紫杉醇治疗复发或转移性胃癌的单臂、开放、剂量递增、多中心I期临床研究(登记号:CTR20161033)”,该试验尚处于受试者招募阶段,首例受试者入组时间为2017年2月8日,共计划入组24人。
8.4 华卟啉钠
华卟啉购货是由中国医学科学院、北京协和医学院药物研究所方起程教授对第1代光敏剂Photofrin进行系统剖析和研究后发现的3个有效成分之一,其光敏活性比Photofrin强10倍。
2013年10月,青龙高科技股份有限公司在新药创制专项的支持下按1.1类递交华卟啉钠原料药与注射用针剂的临床申报,后经特殊审评于2015年4月获准临床。
食管癌-最高状态:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2015年12月24日公示了一项“注射用华卟啉钠治疗标准治疗无效的食管癌患者的耐受性及药物代谢动力学I期临床试验(登记号:CTR20150690)”,该试验尚未启动受试者招募,计划入组34人。
8.5 甲苯磺酸多纳非尼
多纳非尼是由苏州泽璟生物制药有限公司将已上市的索拉非尼分子上的一个甲基取代为三氘代甲基后而开发的1.1类化学新药,药用其甲磺酸盐片剂。多纳非尼可抑制VEGFR、血小板衍生生长因子(PDGF)受体等多种受体酪氨酸激酶的活性,也可直接抑制各种Raf激酶以及下游的Raf/MEK/ERK信号传导通路,抑制肿瘤细胞增殖和肿瘤血管的形成,发挥双重抑制、多靶点阻断的抗肿瘤作用。
2011年12月,泽璟生物制药按1.1类递交了甲磺酸多纳非尼原料药与片的临床申报,后经特殊审评于2012年11月获准临床;2015年4月又在新药创制重大专项的支持下递交了原料药与片剂的补充申报,后于当年10月底获批。
晚期结直肠癌-最高状态:Ⅲ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年9月13日公示了一项“甲苯磺酸多纳非尼片治疗晚期结直肠癌的随机、双盲、安慰剂对照、多中心Ⅲ期临床研究(登记号:CTR20160482)”,该项试验尚处于受试者招募阶段,首例受试者于2016年12月28日入组,共计划入组510人。
晚期食管癌-最高状态:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2016年4月19日公示了一项“甲苯磺酸多纳非尼片治疗二线以上晚期食管癌的开放、单中心IB期临床研究(登记号:CTR20160257)”,该项试验尚未启动受试者招募,第一阶段计划入组19人,中期会议后再决定第二阶段入组人数。
二线晚期鼻咽癌-最高状态:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2016年4月27日公示了一项“甲苯磺酸多纳非尼片治疗二线晚期鼻咽癌的开放、单中心IB期临床研究(登记号:CTR20160252)”,该项试验尚未启动受试者招募,共计划入组44人。
二线以上晚期结直肠癌-最高状态:Ⅰ期,完成受试者招募
药物临床试验登记与信息公示平台于2016年4月12日公示了一项“甲苯磺酸多纳非尼片治疗二线以上晚期结直肠癌的开放、多中心IB期临床研究(登记号:CTR20160218)”,该项试验已经完成受试者招募,首例受试者于2014年6月24日入组,共入组54人。
药物临床试验登记与信息公示平台于2016年4月7日公示了一项“甲苯磺酸多纳非尼片治疗二线以上晚期结直肠癌的开放、多中心IB期临床研究(登记号:CTR20160216)”,该项试验已经完成受试者招募,首例受试者于2015年4月22日入组,共入组47人。
晚期肝细胞(肝)癌-最高状态:Ⅱ/Ⅲ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年4月12日公示了一项“甲苯磺酸多纳非尼片一线治疗晚期肝细胞癌的开放、随机、平行对照、多中心Ⅱ/Ⅲ期临床研究”,登记号为CTR20160184,该试验尚处于受试者招募阶段,计划入组660人,未披露首例受试者入组时间。
药物临床试验登记与信息公示平台于2016年4月12日公示了“甲苯磺酸多纳非尼片治疗晚期肝细胞肝癌的开放、随机、平行对照、多中心IB期临床研究(登记号:CTR20160213)”,该项临床试验已经完成了受试者招募,首例受试者于2014年4月28日入组,共入组108人。
二线以上晚期胃癌-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年4月25日公示了一项“甲苯磺酸多纳非尼片治疗二线以上晚期胃癌的随机、开放、平行对照、单中心IB期临床研究(登记号:CTR20160190)”,该项临床试验尚处于受试者招募阶段,首例受试者入组时间为2016年5月16日,共计划入组40人。
8.7 马来酸吡咯替尼
马来酸吡咯替尼是由江苏恒瑞医药股份有限公司自主研发的EGFR与HER-2不可逆的抑制剂。2011年5月,恒瑞医药按1.1类递交了马来酸吡咯替尼原料药与片剂的临床申报,后经特殊审评于2012年5月获准临床。2015年5月又在新药创制专项的支持下递交了补充申请。
HER表达阳性晚期胃癌-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2015年4月29日公示了“单臂、开放马来酸吡咯替尼单药/联合多西他赛治疗HER2表达阳性晚期胃癌的I期临床耐受性及药代动力学试验(登记号:CTR20150178)”,该项试验尚处于受试者招募阶段,首便受试者于2014年9月16日入组,共计划入组44人。
8.8 麦他替尼氨丁三醇
麦他替尼氨丁三醇是由江苏先声药业与BMS联合开发的一种作用于c-met/VEGFR2的小分子靶向抗肿瘤药。2011年12月,江苏先声药业按1.1类递交了麦他替尼氨丁三醇原料药与片剂的临床申报,后经特殊审评于2012年9月获准临床,且与国外同步批准。
晚期或转移性胃癌、肝癌-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2015年11月4日公示了一项“麦他替尼氨丁三醇片在晚期或转移性胃癌、肝癌患者中单/多次给药耐受性、安全性、初步疗效观察Ⅰb期临床试验(CTR20150743)”,该试验尚处于受试者招募阶段,首例受试者于2015年11月24日入组,共计划入组16~24人。
8.9 沃利替尼
沃利替尼是由和记黄埔医药(上海)有限公司自主研发的小分子c-met抑制剂类抗肿瘤药物。和记黄埔医药于2012年3月按1.1类递交沃利替尼原料药与片的临床申报,后经特殊审评于2013年3月获准临床。和记黄埔医药先后于2013年9月、2015年5月与2016年2月递交了3次补充申报。
晚期胃癌-最高状态:Ⅰ期,已完成,无结果
药物临床试验登记与信息公示平台于2014年11月3日公示了“一项评价沃利替尼联合多西他赛治疗晚期胃癌患者的安全性和药代动力学的Ib期、开放临床研究(登记号:CTR20140736)”,该试验已于2015年12月3日完成,但仅入组4人,远低于计划的40~50人。
8.10 西奥罗尼
西奥罗尼是由深圳微芯生物科技有限责任公司自主研发的小分子靶向抗肿瘤药,其作用靶点包括:AororaB、VEGFR1,2,3、PDGFRα、β,c-Kit。
2012年10月,深圳微芯生物科技有限责任公司按1.1类递交了西奥罗尼原料药与胶囊的临床申报,后经特殊审评于2013年8月获准临床。
晚期肝细胞癌-最高状态:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2017年8月12日公示了一项“西奥罗尼胶囊治疗既往系统治疗失败或不能耐受的晚期肝细胞癌的单臂、多中心、非随机、开放性的临床试验”,登记号为CTR20170936,该项试验尚未启动受试者招募,共计划入组35人。
8.11 盐酸安罗替尼
盐酸安罗替尼是由正大天晴集团药业股份有限公司研发并申报的多靶点小分子抗肿瘤药物,临床前研究显示,该药物可抑制VEGFR-2、VEGFR-3、EGFR、c-Kit、PDGF、FDFR以及c-Met等多种因子。该药于2010年7月递交原料药与胶囊剂的临床申报,经特殊审评于2011年4月获临床批件,并于2014年12月与2015年10月先后两次递交补充申报,其中2014年12月的补充申报受新药创制专项的支持。
2017年3月,正大天晴启动了原料药与胶囊剂的上市申报,且被纳入了优先审评与特殊审评,根据其临床试验公示信息,申请上市的适应证很有可能是非小细胞肺癌。
胃癌、胃食管结合部腺癌-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年2月23日公示了一项“盐酸安罗替尼胶囊治疗晚期胃癌随机双盲、安慰剂平行对照、多中心临床研究(Ⅱ期,登记号:CTR20160073)”,该项试验尚处于受试者招募阶段,首例受试者于2015年7月20日入组,共计划入组378人。
食管鳞癌-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年8月1日公示了一项“盐酸安罗替尼胶囊治疗晚期食管鳞癌随机、双盲、安慰剂对照、多中心II期临床试验(CTR20160078)”,该项临床试验亦尚处于受试者招募阶段,首例受试者于2016年1月14日入组,共计划入组144人。
转移性结直肠癌-最高状态:Ⅱ期,完成受试者招募
临床试验登记与信息公示平台于2015年7月3日公示了“联合最佳支持治疗比较盐酸安罗替尼胶囊与安慰剂在标准治疗后进展的转移性结直肠癌患者中的IIB期临床试验(登记号为:CTR20140777)”,该项临床试验已经完成受试者招募,首例受试者于2014年12月9日入组,共入组421人。
9.血液系统肿瘤
《2015中国癌症统计报告》涉及两种血液系统肿瘤,其中2015年,淋巴瘤预计新增8.82万例,死亡5.21万例,白血病预计新增7.53万例,死亡5.34万例。
9.1 BGB-3111
BGB-3111是由百济神州自主研发的强效、高选择的小分子BTK抑制剂,临床前生化与细胞研究证实其对BTK与EGFR、FCR、FRK、HER2、HER3、ITK、JAK3、LCK、BLK、TEC激酶抑制作用的选择性强于已上市的BTK抑制剂依鲁替尼。与已上市的依鲁替尼具有相同的作用机制。动物研究中,BGB-3111表现出优异的口服生物利用度,并且在组织中具有较依鲁替尼更高的暴露量与更完整的靶标抑制作用。
BGB-3111原料药与胶囊的1.1类临床申报于2015年2月获受理,后经特殊审评于2016年3月获准临床试验。
B细胞淋巴肿瘤-最高阶段:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年5月13日公示了一项“评估BTK抑制剂BGB-3111在中国B淋巴细胞肿瘤患者的安全性、耐受性以及药代/药效动力学特征的Ⅰ期临床研究(登记号:CTR20160204)”,该项试验尚处于受试者招募阶段,首例受试者于2016年7月5日入组,计划入组20人。
复发或难治性套细胞淋巴瘤-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年12月7日公示了一项“Bruton酪氨酸激酶(BTK)抑制剂BGB-3111治疗复发或难治性套细胞淋巴瘤(MCL)有效性和安全性的研究(登记号:CTR20160888)”,该项试验尚处于受试者招募阶段,首例受试者于2017年2月20日入组,计划入组90人。
复发或难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2017年1月4日公示了一项“Bruton酪氨酸激酶(BTK)抑制剂BGB-3111治疗复发或难治性CLL/SLL有效性和安全性的单臂、开放性、多中心、Ⅱ期临床研究(登记号:CTR20160890)”,该试验尚处于受试者招募阶段,首例受试者于2017年3月1日入组,共计划入组80人。
BTK抑制剂治疗复发或难治型Non-GCBDLBCL的临床研究-最高状态:Ⅱ期,受试者招募阶段
药物临床试验登记与信息公示平台于2017年3月6日公示了一项“BTK抑制剂治疗复发或难治型Non-GCBDLBCL的有效性和安全性的单臂、开放性、多中心、Ⅱ期临床研究临床研究(登记号:CTR20170091)”,该项试验尚处于受试者招募阶段,首例受试者于2017年6月30日入组,计划入组100人。
复发或难治型华氏巨球蛋白血症(WM)-最高状态:Ⅱ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2017年4月12日公示了一项“BTK抑制剂BGB-3111治疗复发或难治型华氏巨球蛋白血症(WM)有效性和安全性的单臂、开放性、多中心、Ⅱ期临床研究(登记号:CTR20170208)”,该项试验尚未启动受试者招募,计划入组40人。
国外临床试验
百济神州网站上披露了多项国外临床试验的阶段性成果(https://www.beigene.com/)
9.2 CM082
CM082是由卡南吉医药科技(上海)有限公司通过VIC模式(即:风投+知识产权项目+CRO外包服务)进行开发的一种可同时抑制VEGFR与PDGFR的小分子靶向药物,另有报道称,其作用靶点还包括;c-kit与flt3。CM082原料药与胶囊剂的1.1类临床申报最早于2011年5月获受理,后经特殊审评于2012年4月获准临床。该药除了肿瘤适应证,还拟用于治疗湿性年龄相关性黄斑变性。
急性髓系白血病-最高状态:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2016年10月11日公示了一项“CM082片治疗难治性和复发性Flt-3阳性急性髓系白血病的安全性和耐受性Ⅰ期临床试验(登记号:CTR20160487)”,该项试验尚未启动受试者招募,共计划入组9人。
9.3 DTRMWXHS-12
DTRMWXHS-12是由浙江导明医药科技有限公司研发的BTK受体酪氨酸激酶抑制剂类小分子靶向抗肿瘤药。其原料药与胶囊剂的1.1类新药临床申报于2015年7月获受理,后经特殊审评于2016年5月获准临床。
B细胞淋巴瘤-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年9月13日公示了一项“评估BTK激酶抑制剂DTRMWXHS-12在B-细胞淋巴瘤患者中的安全性、耐受性、药代动力学的Ⅰa临床研究”,登记号为CTR20160663,已启动受试者招募,首例受试者于2016年11月2日入组,共计划入组18~36人。
9.4 HAO472
HAO472是由江苏恒瑞医药股份有限公司开发的一种水溶性冬凌草甲素衍生物,分子式为C25H34F3NO9,临床前研究证实,HAO472能显著抑制抗CD3/CD28磁珠诱导的淋巴细胞增殖,并呈剂量和时间的依赖性关系。
恒瑞医药按1.1类递交的HAO472原料药注射用剂型临床申报于2013年5月获CDE受理,后经特殊审评于2013年10月获准临床。
急性髓性细胞白血病
药物临床试验登记与信息公示平台于2015年7月2日公示了一项“HAO472治疗复发/难治的M2b型急性髓性细胞白血病的(AML)的多中心、开放、剂量递增的I期临床试验(登记号:CTR20150246)”,该项试验尚未启动受试者招募,共计划入组38人
9.5 SKLB1028
SKLB1028由石药集团与四川大学联合研发的一种新型多靶点蛋白激酶抑制剂,主要作用靶点包括FLT3、EGFR、Abl、Fyn、Hck、Lck、Lyn、Ret及Yes。临床前药理实验显示其对白血病、非小细胞肺癌等多种肿瘤,特别是FLT3-ITD突变的急性髓性白血病具有很好的抑制作用,及有良好的耐受性。
2014年3月,石药集团中奇制药技术(石家庄)有限公司在新药创制专项的支持下递交了SKLB1028的临床申报,而后经特殊审评于2016年2月获准临床。
FLT3突变的急性髓性白血病-最高阶段:Ⅰ期,尚未启动受试者招募
药物临床试验登记与信息公示平台于2017年5月25日公示了一项“XCCS605B在晚期肿瘤患者中单独和联合吉西他滨治疗的Ⅰ期临床试验(登记号:CTR20160796)”,该项试验尚未启动受试者招募,计划入组35~44人。
9.6 马来酸艾维替尼(AC0010)
马来酸艾维替尼(AC0010)是由杭州艾森医药研究有限公司在新药创制专项的支持下研发的第三代EGFR酪氨酸激酶抑制剂类小分子靶向抗肿瘤药物,其能克服T790M突变所致的耐药,其结构式如下图所示。
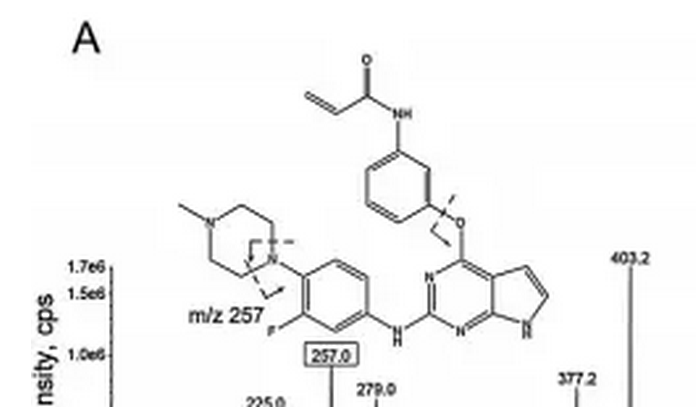
艾森医药在新药创制专项支持下按1.1类递交的马来酸艾维替尼原料药与胶囊剂的临床申报于2013年8月获CDE受理,后经特殊审评于2014年9月获准临床;而后在新药创制专项的支持下递交的补充申报亦于2016年6月获CDE受理,并于9月获准。
复发或难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、套细胞淋巴瘤、弥漫性大B-细胞淋巴瘤等非霍奇金淋巴瘤-最高状态:Ⅰ期,受试招募阶段
药物临床试验登记与信息公示平台于2017年3月7日公示了一项“马来酸艾维替尼胶囊治疗复发或难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤等非霍奇金淋巴瘤的I期临床试验(登记号:CTR20170108)”,该项试验尚处于受试者招募阶段,首例受试者于2017年3月9日入组,共计划入组184人。
9.10 氢溴酸布利沙福
氢溴酸布利沙福是由台湾太景生物科技控股股份有限公司研发的CXCR4趋化因子受体抑制剂类抗肿瘤药,并由其北京子公司于2015年5月(报原料药与注射用剂型)与2014年7月(报注射用剂型)按1.1类先后两次报临床,后经特殊审评分别于2013年5月与2015年11月获准临床。
复发或难治性髓系白血病-Ⅰ期,已完成,无结果披露
药物临床试验登记与信息公示平台于2016年4月7日公示了一项“评估布利沙福并用阿糖胞苷及氟达拉滨治疗复发或难治性急性髓系白血病成人患者安全性及有效性的I期临床研究(登记号:CTR20130291)”,该项试验于2015年7月28日入组首例受试者,并于2017年4月20日完成试验,共入组15人。
9.11 双替尼他
双替尼他是由广州必贝特医药技术有限公司研发的PI3K与HDAC双靶点抑制剂类小分子靶向抗肿瘤药。原料药与胶囊剂的1.1类新药临床申报于2014年4月获CDE受理,后经特殊审评于2015年7月获准临床。
复发难治淋巴瘤、多发性骨髓瘤和慢性淋巴细胞白血病-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2016年9月26日公示了一项“多中心、开放、评价注射用BEBT-908(即双替尼他)治疗复发难治淋巴瘤、多发性骨髓瘤和慢性淋巴细胞白血病的Ⅰ期临床研究(登记号:CTR20160223)”,该项试验已启动受试者招募,首例受试者于2016年3月14日入组,共计划入组54人。
9.12 西奥罗尼
西奥罗尼是由深圳微芯生物科技有限责任公司自主研发的小分子靶向抗肿瘤药,其作用靶点包括:AororaB、VEGFR1,2,3、PDGFRα、β,c-Kit。
2012年10月,深圳微芯生物科技有限责任公司按1.1类递交了西奥罗尼原料药与胶囊的临床申报,后经特殊审评于2013年8月获准临床。
复发性难治性霍奇金淋巴瘤-最高状态:Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2017年4月10公示了一项“西奥罗尼胶囊治疗复发难治非霍奇金淋巴瘤的单臂、多中心、非随机、开放性探索疗效和安全性的临床试验”,登记号为CTR20170246,该项临床试验尚处于受试者招募阶段,首例受试者于2017年5月9日入组,共计划入组29人。
9.13 盐酸卡呋色替
盐酸卡夫色替是由江苏豪森药业股份有限公司研发的PLK-1抑制剂类小分子靶向抗肿瘤药物。目前专业期刊中与之相关的信息较少。
2012年9月,江苏豪森药业股份有限公司及其子公司连云港宏创医药有限公司分别按1.1递交了盐酸卡呋色替的注射用制剂与原料药,后经特殊审评于2013年6~7月间获准临床。
急性髓性白血病-Ⅰ期,受试者招募阶段
药物临床试验登记与信息公示平台于2014年12月3日公示了一项“卡呋色替联合低剂量阿糖胞苷在无法耐受化学治疗的复发/难治性急性髓系白血病患者中的安全性和PK/PD研究(Ⅰ期,登记号:CTR20131374)”,该项试验尚处于受试者招募阶段,首例受试者于2014年5月14日入组,共计划入组50人。
10. 尚未明确具体类型的实体瘤
此类药物尚未在临床试验公示信息中明确具体的适应证类别。
10.1 ACC006
ACC006是由扬州艾迪生物科技有限公司研发的1.3类新药,即“用拆分或合成等方法制得的已知药物中的光学异构体及其制剂”,扬州艾迪未披露该药的任何信息,然而该公司申请的与光学拆分相关的专利仅涉及伊曲康唑,并且指出,拆分所得的2S,4R,2’S-伊曲康唑晶型具有良好的抗肿瘤活性,因此可以推测,ACC006就是2S,4R,2’S-伊曲康唑。
ACC006原料药与口服液的新药临床申报于2016年2月获CDE受理,后经特殊审评于2016年10月获准临床。
药物临床试验登记与信息公示平台仅于2017年5月5日公示了一项“ACC006口服溶液在晚期实体瘤患者中耐受性及药代动力学Ⅱ期临床研究(登记号:CTR20170407)”,该项试验尚未启动受试者招募工作,共计划入组27~41人。
10.2 AL2846
AL2846是c-met酪氨酸激酶受体抑制剂,抑制其他Flt4、血管内皮生长因子受体、和Ron的酪氨酸激酶受体。在人类的胃癌SGC 7901、乳腺癌MDA-MB-435、结肠癌colo205和肾细胞癌786-O各种异种模型中AL2846已经被证实具有显著活性,AL2846也具有良好的生物利用度。
药物临床试验登记与信息公示平台仅于2016年8月15日公示了一项“AL2846胶囊耐受性和药代动力学Ⅰ期临床试验(登记号:CTR20160537)”,该项试验以晚期恶性实体瘤患者为研究对象,尚处于受试者招募阶段,计划入组20~50人,但暂未披露首例受试者入组时间。
10.3 AL8326
AL8326是由南京爱德程医药科技有限公司研发的一种多靶点激酶抑制剂,主要抑制c-Kit、成纤维细胞生长因子、血管内皮生长因子 (Flt1, Flt4 and KDR)血小板衍生生长因子和 Ret的酪氨酸激酶受体。在大鼠药代动力学资料中,AL8326口服给药也有良好的效果,半衰期为1.8小时,生物利用度良好。
AL8326原料药与片剂的新药临床申报(1.1类)于2014年12月获受理,后经特殊审评于2016年2月获准临床。
药物临床试验登记与信息公示平台于2017年2月3日公示了一项“一项在晚期实体瘤患者中进行 AL8326的单药单次、多次剂量递增耐受性和药代动力学研究(登记号:CTR20170045)”,该项试验尚未启动受试者招募,计划入组20~40人。
10.4 APG-1387
APG-1387是由江苏亚盛医药公司研发的一种IAP(凋亡抑制蛋白)二聚体抑制剂,其对XIAP、c IAP1和c IAP2亚型的Ki分别为1、30、20 nmol/L。体外研究显示,APG-1387在1~10 nmol/L时,可诱导c IAP1 降解,有效抑制大量人癌症细胞系。APG-1387在MDA-MB-231和SK-OV-3 的荷瘤动物中的IC50分别为10和23 nmol/L。APG-1387单药对三阴性乳腺癌MDA-MB-231细胞有一定的增殖抑制作用,EGFR抑制剂对 MDA-MB-231细胞几乎没有影响,两药联用较APG-1387 单药有明显的增殖抑制作用和促凋亡作用(P<0.01),其机制可能与联合用药降低p-ERK1/2水平以及激活凋亡通路有关。此,可以推断,APG-1387和 EGFR抑制剂的联合用药,在三阴性乳腺癌的临床治疗中将会有良好的应用前景。
亚盛医药在新药创制重大专项的支持下递交的APG-1387原料药与注射用剂型的临床申报于2013年6月获CDE受理,而后经特殊审评于2014年12月获准临床。
药物临床试验登记与信息公示平台于2015年4月3日公示了一项“APG-1387治疗晚期实体瘤患者的开放性剂量爬坡I期临床试验的安全性、耐受性以及药代动力学/药效动力学研究(登记号:CTR20150161)”,该项临床试验以晚期实体瘤患者为对象,尚处于受试者招募阶段,首例受试者于2015年4月2日入组,共计划入组30~50人。
10.5 BGB-283
BGB-283是百济神州研发的口服、选择性第2代BRAF抑制剂,2013年6月,百济神州以2.33亿美元的价格向德国默克公司转让了BGB-283除中国以外的其他地区研发和销售权。
BGB-283原料药与胶囊剂的临床申报(1.1类,新药创制专项支持)于2014年5月获CDE受理,后经特殊审评于2015年7月获准临床,拟用于治疗大肠癌或黑色素瘤。
药物临床试验登记与信息公示平台于2015年10月8日披露了一项“评价BGB-283在中国恶性实体瘤患者的安全性、耐受性、药代动力学特征以及食物影响和初步疗效的Ⅰ期研究(登记号:CTR20150575)”,该项试验尚处于受试者招募阶段,首例受试者于2015年10月8日入组,计划入组45人。
10.6 BGB-290
BGB-290是由百济神州开发的口服PARP抑制剂,并将BGB-290除中国以外其他地区的开发与销售权转让给德国默克公司。
BGB-290原料药与胶囊剂的1.1类新药临床申报于2015年11年获CDE受理,后经特殊审评于2016年8月获准临床。
药物临床试验登记与信息公示平台于2016年12月7日公示了一项“评估BGB-290在中国晚期实体肿瘤患者的安全性、药代动力学和抗肿瘤活性的Ⅰ期、开放、多中心的剂量递增、扩展研究”,登记号为CTR20160828,该项试验尚未启动受试者招募,计划入组36~88人。
10.7 C118P
C118P是南京圣和药业自主研发的微管蛋白类抗肿瘤药,与紫杉醇等相似,C118P通过作用于微管蛋白而产生抗肿瘤药物。但是相比于紫杉醇,C118P还具有肿瘤新生血管抑制作用,能在攻击癌细胞的同时,通过抑制新生血管而“饿死”癌细胞。
南京圣和药业股份有限公司在新药创制专项的支持下按1.1类递交的C118P原料药与注射用制剂临床申报于2014年8月获CDE受理,后经特殊审评于2015年批准临床。
药物临床试验登记与信息公示平台于2016年5月9日公示了一项“注射用C118P在恶性实体肿瘤患者中单/多次给药剂量递增Ia期临床研究(登记号:CTR20160255)”该项临床试验尚未启动受试者招募,计划入组27人。
10.8 CM118
CM118是由上海再新医药科技有限公司申报的同时作用于c-met与ALK两种靶点的小分子靶向抗肿瘤药。国内有博士论文研究显示,CM118对ALK与c-met抑制作用的IC50分别为60±10nM与40±5nM。该药原料与片剂的1.1类临床申报于2014年10月获CDE受理,后经特殊审评于2016年3月获准临床。
药物临床试验登记与信息公示平台于2016年9月30日公示了一项“CM118片治疗晚期恶性肿瘤患者的安全性、耐受性、药代动力学与初步疗效的Ⅰ期临床研究(登记号:CTR20160477)”,该项试验尚处于受试者招募阶段,计划入组35人,但暂未披露首例受试者入组时间。
10.9 HMPL-453酒石酸盐
HMPL-453是和记黄埔医药开发的一种靶向成纤维细胞生长因子受体(FGFR)的新型高选择性小分子抑制剂,其与其他药物相比表现出药效强,激酶选择性高及安全性更佳的特点。和记黄埔医药正在澳大利亚展开HMPL-453的一项Ⅰ期临床研究(NCT02966171)。
HMPL-453酒石酸盐原料药与片剂的1.1类新药临床申报于2016年2月获CDE受理,后经特殊审评于2016年11月获准临床。
药物临床试验登记与信息公示平台于2017年7月28日公示了一项“评价HMPL-453治疗晚期恶性实体肿瘤患者安全性、耐受性、药代动力学和初步抗肿瘤活性的多中心、开放的Ⅰ/Ⅱ期临床研究(登记号:CTR20170175)”,该项试验已启动受试者招募,首例受试者于2017年6月23日入组,共计划入组81人。
10.10 HS-10241
HS-10241是由江苏豪森药业股份有限公司自主研发的c-met抑制剂类小分子靶向抗肿瘤药,其原料药(连云港宏创药业有限公司)与片剂的1.1类临床申报于2015年4月获CDE受理,后经特殊审评于2016年3月获准临床。
最近的,药物临床试验登记与信息公示平台于2017年7月14日公示了一项“HS-10241单药及联合甲磺酸阿帕替尼在晚期实体瘤患者中的耐受性、安全性、药代动力学及疗效的Ⅰ期临床研究(登记号:CTR20170749)”,该试验尚处于受试者招募阶段,首例受试者于2017年8月16日入组,共计划入组80人。
此前,药物临床试验登记与信息公示平台还于2017年3月3日公示了一项“评价单次和多次口服c-MET激酶抑制剂HS-10241在晚期实体瘤受试者中安全性、耐受性和药代动力学特性的临床研究(登记号:CTR20160577)”,该试验亦尚处于受试者招募阶段,首例受试者于2016年12月27日入组,共计划入组41~68人。
10.11 IMP4297
IMP4297是由上海瑛派药业有限公司研发的PARP抑制剂类小分子抗肿瘤药,根据美国癌症协会(AACR)107届年会上的一篇报告,IMP4297具有1-苄基喹唑啉-2,4(1H,3H)-二酮的结构母核。
IMP4297原料药与胶囊剂的1.1类新药临床申报于2016年4月获受理,后经特殊审评于2017年7月获准临床。
药物临床试验登记与信息公示平台于2017年4月5日公示了一项“评价 IMP4297 胶囊在标准治疗无效的晚期实体瘤患者中的安全性、耐受性及药物代谢动力学特征的期临床试验(登记号:CTR20170271)”,该项试验已启动受试者招募,共计划入组30人,但暂未披露首例受试者入组时间。
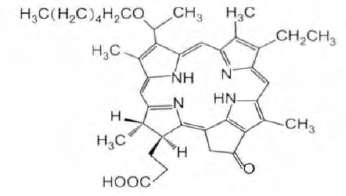
10.12 NPPH
NPPH是由浙江海正药业股份有限公司开发的第二代抗肿瘤光敏剂,分子式为C39H48N4O4,相对分子量为636.37,属于结构单一、长激发波长、暗毒性小的二氢卟酚类,其化学结构式如下图所示。
NPPH具有很好的光动力活性,理想的作用光谱以及很好的靶向性,对肿瘤组织的穿透率高,较第一代光敏剂相比,其光毒性明显降低,基本无须避光,用量小、使用方便,是一种极具市场潜力的光动力疗法。
海正药业按1.1类递交的NPPH原料药与注射用剂型临床申报于2013年2月获CDE受理,后经特殊审评于2014年7月获准临床。
药物临床试验登记与信息公示平台于2016年11月22日公示了一项“注射用HPPH剂量递增光动力治疗肿瘤患者的Ⅰ期安全性、耐受性、药代动力学临床研究”,登记号为CTR20160425,该项临床试验以食管癌、皮肤癌等肿瘤的患者为研究对象,尚处于受试者招募阶段,首例受试者于2015年5月3日入组,计划入组30人,已入组20人。
10.13 SC10914
SC10914是由江苏青峰药业有限公司研发的PARP抑制剂类小分子抗肿瘤药物,该类药物通过抑制肿瘤细胞DNA损伤修复、促进肿瘤细胞发生凋亡,从而增效放疗及烷化剂和铂类药物化疗的疗效。
青峰药业递交的SC10914原料药与片剂的临床申报于2015年6月获CDE受理(1.1类),后经特殊审评于2016年8月获准临床。
药物临床试验登记与信息公示平台于2016年9月27日公示了一项“评价SC10914在晚期实体肿瘤患者中的安全性、耐受性,药代动力学/药效动力学及初步疗效的I期临床研究(登记号:CTR20160752)”,该试验尚未启动受试者招募工作,计划入组38~66人。
10.14 SHR7390
SHR7390是由江苏恒瑞医药股份有限公司研发的靶向MEK1/2的选择性小分子抑制剂。恒瑞医药按1.1类递交的SHR7390原料药与片剂的临床申报于2014年12月获CDE受理,后经特殊审评于2016年3月获准临床,拟用于结肠癌、肺癌、黑色素瘤等实体肿瘤的治疗。
药物临床试验登记与信息公示平台于2016年9月27日公示了一项“SHR7390片在晚期实体瘤患者中的耐受性及药代动力学I期临床研究(登记号:CTR20160718)”,该项试验尚处于受试者招募阶段,首例受试者于2016年12月20日入组,计划入组60人。
药物临床试验登记与信息公示平台还于2017年6月30日公示了一项“SHR7390联合SHR-1210在晚期实体瘤患者中的耐受性及药代动力学I期临床研究(登记号:CTR20170611)”,该项试验尚未启动受试者招募,计划入组60人。其中的SHR-1210是由恒瑞医药自主研发的PD-1单抗类治疗用生物制品,该单抗于2016年2月获准临床,属于新药创制重大专项支持的项目。
10.15 XCCS605B
XCCS605B是一种具有选择性的激酶抑制剂,可用于抗肿瘤增效剂,药理试验表明,联合用药能够显著增效DNA损伤药物如吉西他滨对肿瘤细胞的增殖抑制作用。
2014年12月,浙江医药股份有限公司新昌制药厂按1.1类递交了XCCS605B原料药与注射用剂型的临床申报,后经特殊审评于2016年2月获准临床,其拟定适应证为结肠癌、胰腺癌、乳腺癌。
药物临床试验登记与信息公示平台于2017年5月25日公示了一项“XCCS605B在晚期肿瘤患者中单独和联合吉西他滨治疗的Ⅰ期临床试验(登记号:CTR20160796)”,该项试验以晚期恶性肿瘤患者为研究对象,尚未启动受试者招募,计划入组35~44人。
10.16 艾诺赛特(ACP)
艾诺赛特是由上海奥奇医药科技有限公司申报的一种1.1类新药,目前与之相关的信息极为匮乏。根据上海奥奇仅有的两件国内专利申请判断,艾诺赛特很有可能是一种具有A-失碳-5α雄甾烷的血管生成抑制剂类抗肿瘤药。
上海奥奇按1.1类递交的艾诺赛特原料药与胶囊剂临床申报于2013年3月获受理,后经特殊审评于2014年3月获准临床。
药物临床试验登记与信息公示平台于2015年1月12日公示了一项“艾诺赛特在晚期实体瘤患者中单次和多次口服给药的Ⅰ期临床试验(CTR20160755)”,该项试验以晚期实体瘤患者为研究对象,首例受试者于2014年12月25日入组,已于2016年12月15日完成试验,共入组42人。
10.17 安替安吉肽
安替安吉肽属是一种含有18个氨基酸的新型整合素阻断剂类多肽,临床前体内外研究均证实该多肽对于胃癌、非小细胞肺癌、肝癌以及结直肠癌等肿瘤具有良好的抑制效果。
内蒙古天奇药业集团有限公司的前身内蒙古奇特生物高科技术(集团)有限公司于2012年5月按1.1类递交了安替安吉肽原料药与注射用剂型的临床申报,后经特殊审评与2013年9月获准临床。2015年10月,赛升药业以5000万元的成交价,购得该药原料药与制剂的临床批件。
药物临床试验登记与信息公示平台于2015年7月20日公示了一项“注射用安替安吉肽(HM-3)单药治疗晚期恶性实体肿瘤Ⅰa期临床研究(登记号:CTR20150368)”,该项试验以晚期恶性实体瘤患者为研究对象,尚处于受试者招募阶段,计划入组36人,但暂未披露首例受试者入组时间。
10.18 谷美替尼
谷美替尼是由上海药物研究所开发,后转让给绿谷制药C-MET抑制剂类小分子靶向抗肿瘤药,其原料药与片剂的1.1类新药临床申报于2016年3月获受理,后经特殊审评于2017年1月获准临床。
药物临床试验登记与信息公示平台于2017年8月12日公示了一项“一项评估SCC244在晚期实体瘤患者中的安全性、药代动力学和抗肿瘤活性的Ⅰ期临床研究(登记号:CTR20170161)”,此为一项国际多中心临床试验,共计划招募113人,其中中国73人。
10.19 环米德吉
环米德吉是由江苏恒瑞医药股份有限公司开发的Hedgehog通路抑制剂,是国外已上市药物vismodegib类似物。
恒瑞医药按1.1类递交的环咪德吉原料药与片剂的临床申报于2013年6月获CDE受理,后经特殊审评于2014年5月获准临床。
药物临床试验登记与信息公示平台于2015年4月23日公示了一项“环咪德吉片在肿瘤患者中单次和多次给药的安全性及药代动力学研究的Ⅰ期临床试验(登记号:CTR20150231)”,该项试验尚处于受试者招募阶段,首例受试者入组时间为2014年11月19日,共计划入组30人。
10.20 凯泰酮胺
凯泰酮胺是由广州顺健生物医药科技有限公司于2014年9月按1.1类递交临床申报的第二代c-met抑制剂类小分子靶向抗肿瘤药物,后经特殊审评于2016年2月获准临床,拟药用胶囊剂。2014年4月,广药集团以引进创新团队的形式将该药收入旗下。专业数据库中与之相关的信息较少。
药物临床试验登记与信息公示平台仅于2016年3月18日公示了一项“HQP8361(即凯泰酮胺)治疗晚期实体瘤患者剂量递增的Ⅰ期临床试验(登记号:CTR20160141)”,该试验以晚期实体瘤患者为研究对象,尚处于受试者招募阶段,首例受试者于2016年4月21日入组,共计划入组25~40人。
10.21 康布斯汀
康布斯汀是我国自主研发的首个破坏肿瘤脉管系统的抗肿瘤药物,结构式如下图所示。
康布斯汀的作用机制不同于血管生成抑制剂类药物,后者只能阻止新血管的生成,而康布斯汀能针对肿瘤的血管显示出特异性靶向和破坏已生成的肿瘤血管,使肿瘤得不到氧气和营养,直至肿瘤饿死。
上海华理生物医药有限公司于2012年3月按1.1类递交康布斯汀原料药与注射用针剂的临床申报,后经特殊审评于2012年12月获批进入临床试验。
药物临床试验登记与信息公示平台仅于2016年1月26日公示了一项“注射用康布斯汀单次和多次给药耐受性及药代动力学研究(登记号:CTR20150849)”,该项试验以恶性实体瘤患者为研究对象,但尚未启动受试者招募,计划入组13~27人。
10.22 康尼替尼
康尼替尼是由北京康辰药业有限公司自主研发的一种小分靶向抗肿瘤药。2015年9月,在新药创制专项的支持下按1.1类递交了原料药与片剂的临床试验,后经特殊审评于2016年4月获准临床。专业数据库中与之相关的信息较少。
药物临床试验登记与信息公示平台仅于2016年10月29日公示了一项“评价康尼替尼治疗复发或转移性恶性实体肿瘤的安全性、耐受性和药代动力学的开放、剂量递增的I期临床研究”,登记号为CTR20160734,该项试验以恶性实体瘤患者为研究对象,尚处于受试者招募阶段,首例受试者入组时间为2017年3月1日,共计划入组45人。
10.23 磷酸源生萘啶
磷酸源生萘啶是广州源生医药科技有限公司申报的wnt通路抑制剂,用于治疗肿瘤和纤维化重大疾病。2015年7月6日,在新药创制专项的支持下按1.1类递交了临床申报,后于2016年4月获批临床。专业数据库中与之相关的信息较少。
药物临床试验登记与信息公示平台仅于2017年5月18日公示了一项“磷酸源生萘啶(CGX1321)治疗晚期胃肠道癌症的开放性剂量递增研究(I期,登记号:CTR20170070)”,该项试验是晚期胃肠道癌症患者为研究对象,处于受试者招募阶段,暂无首例受试者入组时间的信息,共计划入组50人。
10.24 马来酸舒布替尼
马来酸舒布替尼是由连云港润众制药有限公司(报原料)与江苏正大天晴药业股份有限公司(报胶囊制剂)于2011年9月联合申报的1.1类化药新药,本品是一种小分子多靶点受体酪氨酸激酶抑制剂,其作用靶点包括:VEGFR1、VEGFR2、VEGFR3、c-kit与PDGFR。2012年8月完成特殊审批,获准临床。
药物临床试验登记与信息公示平台于2015年11月9日公示了一项“马来酸舒布替尼胶囊耐受性和药代动力学Ⅰ期临床试验(登记号:CTR20130334)”,该项试验以晚期恶性实体瘤患者为研究对象,考察舒布替尼的药代动力学与药效动力学,并已完成受试者招募,首例受试者于2013年4月2日入组,共入组23人。
10.25盐酸哌罗替尼
盐酸哌罗替尼是由四环医药控股集团有限公司的全资子公司山东轩竹医药科技有限公司自主开发的新一代针对EGFR家族的广谱、不可逆的受体酪氨酸激酶抑制剂类抗肿瘤药物。2013年12月,轩竹医药科技按1.1类递交了盐酸哌罗替尼原料药与片剂的临床申报,后经特殊审评于2015年8月获准临床。本品先前于2014年11月获FDA批准在美国进行临床试验。
药物临床试验登记与信息公示平台仅于2015年12月1日公示了一项“KBP-5209(即盐酸哌罗替尼)治疗晚期实体肿瘤的I期临床研究(登记号:CTR20150792)”,该项试验以晚期实体瘤患者为研究对象,考察哌罗替尼的药代动力学与药效动力学,但尚处于受试者招募阶段,计划入组48人,但却未披露首例受试者入组时间。
11. 总结
2017年4月,全球规划最大的基于癌症激酶靶点的高能量细胞筛选库在中国科学院强磁场科学中心建成。该细胞库囊括了近70种癌症激酶靶点,细胞种类达150余种,几乎覆盖了目前已知的与肿瘤发生发展相关的全部激酶及激酶突变细胞。该细胞库的建成,填补了国内新药创制领域此类检测体系的空白,将为抗肿瘤新药研发提供有力支撑。
正是由于癌症治疗中存在的众多作用靶点,抗肿瘤药物的研发成为国内外新药研制最为活跃的领域之一,国内企业也在其中展露头脚。贝达药业自主研发并于2011年获准生产的盐酸埃克替尼片(商品名“凯美纳”),为国内企业小分子抗肿瘤药物的自主研发树立了良好的典范。凯美纳不仅在上市后为贝达药业带来了丰厚的市场回报,更被前卫生部部长誉为“民生领域堪比两弹一星的重大突破”。在商业利益的驱动下、国家政策的支持下,为了满足国内公众卫生对抗肿瘤药的需求,国内企业纷纷投入新型抗肿瘤药物的研发,并有近百种小分子抗肿瘤药物获得了临床批件。
启动临床试验,是新药研发中具有里程碑意义的一步,是将批件产业化的重要环节,也是药物信息披露的一个时间节点,因此本文重点考察了已进入临床试验公示阶段的国内企业自主研发的小分子抗肿瘤药物的临床试验进展。当然在考察中发现,相当数量的临床试验的首例受试者入组时间会早于临床试验的公示时间,因此无法排除已经进入试验阶段但尚未公示的情况,笔者将密切跟踪此类药物的进展。
最后,由于笔者精力与能力的限制,纳入考察的药物品种与各药物的信息,均会有所遗漏,还望广大读者不吝补充、斧正。

